(adsbygoogle = window.adsbygoogle || []).push({});
Para que os físicos e químicos chegassem ao conhecimento da estrutura do átomo que se tem hoje, vários foram os modelos elaborados ao longo da história. O primeiro modelo atômico foi proposto por Dalton, em 1808. A partir disso, outros modelos surgiram, como o modelo atômico de Thomson, o de Rutherford e, por fim, o modelo atômico de Bohr.
Este último, também chamado de modelo atômico de Rutherford-Bohr, foi desenvolvido pelo físico Niels Henry David Bohr. Rutherfor e Bohr trabalharam juntos para entender as falhas que os modelos atômicos anteriores possuíam. Com isso, as análises e testes ficaram mais fáceis, por mais que apresentassem, também, algumas falhas.
De forma geral, o modelo atômico de Bohr mostrou como os elétrons estão distribuídos na eletrosfera a partir da quantidade de energia. O físico denominou cada órbita da eletrosfera como órbitas estacionárias. Além disso, propôs explicações sobre o comportamento do átomo de hidrogênio.
(adsbygoogle = window.adsbygoogle || []).push({});Modelo atômico de Bohr
Para chegar ao modelo atômico de Bohr, precisamos entender o processo histórico. Isso porque, foi a partir dos estudos de Ernest Rutherford que Bohr conseguiu chegar a algumas conclusões. Importante destacar que, ambos os físicos trabalharam juntos e, por isso, o modelo de Bohr também é conhecido como modelo atômico de Rutherford-Bohr.
Bem, em 1911, Rutherford criou o modelo atômico que dizia que os átomos possuíam cargas positivas. Essas cargas estariam dispostas num núcleo muito pequeno, denominado núcleo atômico. Ou seja, mais tarde, foi descoberto que o interior do átomo é formado por partículas positivas, os prótons, e por partículas neutras, os nêutrons.
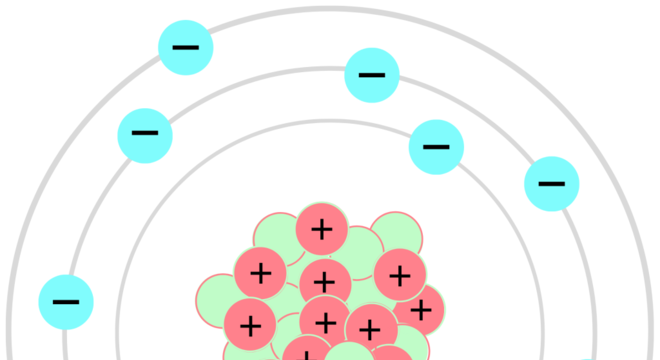
Rutherford também foi responsável, em 1917, por realizar experimentos de divisão atômica. Por conta disso, o físico é considerado o pai da Física Nuclear. Entretanto, o modelo criado por Rutherford deixou algumas lacunas. Assim, Bohr utilizou os estudos já criados para aprofundar melhor os conceitos.
Rutherford e Bohr, nesse sentido, começaram a trabalhar juntos. Bohr conseguiu chegar à explicação de como o átomo de hidrogênio se comportava. Tal explicação, por exemplo, não era possível apenas com o modelo atômico de Rutherford. Apesar das melhorias, o modelo atômico de Bohr não era perfeito e também possuía falhas. A partir disso, o físico se propôs a aperfeiçoar o modelo estudado.
google_ad_client = "ca-pub-1360360021251685"; google_ad_slot = "7008382253"; google_ad_width = 200; google_ad_height = 90;Quarks, o que são? Definição, tipos e características
×Conclusões de Bohr
De forma geral, o modelo atômico de Bohr diz respeito à distribuição dos elétrons a partir da quantidade de energia que cada partícula possui na eletrosfera. Por conta disso, o modelo atômico também é conhecido como modelo quântico. Bohr utilizou como base para chegar às suas conclusões a teoria quântica de Max Planck.
De acordo com essa teoria, a energia liberada em cada partícula ocorre por meio de “pacotes”. Ou seja, os pacotes de energia representam camadas e as partículas não são liberadas de forma contínua. Além disso, os pacotes de energia são chamados de quantum.
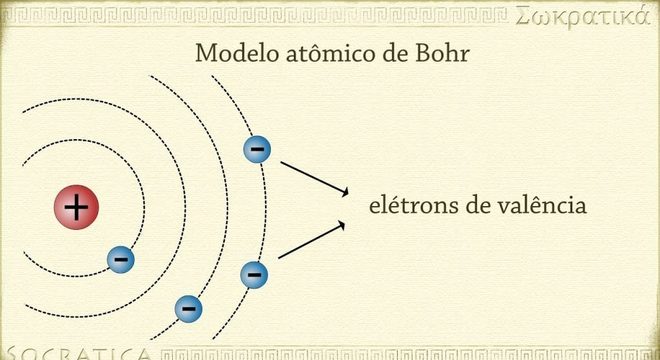
A partir disso, Bohr chegou à conclusão que os elétrons presentes na eletrosfera estariam postos em órbitas circulares, denominadas de órbitas estacionárias. Dessa forma, cada elétron adquire uma quantidade específica de níveis de energia. Ou seja, Bohr determinou a quantização da energia atômica.
(adsbygoogle = window.adsbygoogle || []).push({});
Além do mais, o físico mostrou que cada elétron possui uma órbita específica. Quando a energia desse elétron aumenta, consequentemente, ele muda de órbita e se afasta do núcleo atômico. Vale ressaltar que, ao consumir energia, o nível energético do elétron aumenta. Por outro lado, quando o elétron produz energia, o consumo diminui.
As camadas eletrônicas, ou seja, os níveis de energia da eletrosfera, possuem números específicos de energia (n) = 1, 2, 3, 4, 5, 6 e 7, e são representados por letras, como K, L, M, N, O, P, Q. Porém, o modelo atômico de Bohr só funciona caso o átomo apresente o mesmo número de elétrons, como o hidrogênio.
Por conta das falhas do modelo de Bohr, a partir da década de 20, físicos como Erwin Schrödinger, Louis de Broglie e Werner Heisenberg começam a desenvolver o modelo de forma mais aprofundada. Foi por meio desses estudos que a estrutura atômica pôde ser desenvolvida.
Onde o modelo atômico de Bohr é aplicado?
O modelo atômico de Bohr estava ligado à Mecânica Quântica. Por meio desse estudo, é possível analisar o que ocorre com os fogos de artifício ou com os letreiros luminosos. No caso dos fogos, o que ocorre é liberar de energia adquirida quando o elétron muda de camada, ou seja, a órbita.
Quando o elétron muda de órbita e volta ao estado original, cada partícula libera a energia em forma de luz, denominada de fóton. Cada elemento químico apresenta níveis de energia diferentes. Sendo assim, ao liberaram luz no espectro visível, cada partícula vai emitir uma cor relacionada a energia liberada.
Os letreiros luminosos, por exemplo, também utilizam dos princípios do modelo atômico de Bohr. O elemento químico utilizado para gerar o efeito das luzes é o gás neônio (Ne). Neste caso, os letreiros funcionam a partir da excitação dos elétrons e, quando retornam à camada original, liberam energia em forma de luz. Assim, podemos ver diferentes cores de luzes por conta da composição, da pressão do gás e da diferença de potencial.
E aí, o que achou da matéria? Se gostou, confira também o que são Quarks e quais os principais tipos de Ondas Mecânicas.
Fontes: Toda Matéria, Quero Bolsa e Brasil Escola
Imagens: Brainly, Ciências Naturales, Kuadro e Aprendizagem conectada
(adsbygoogle = window.adsbygoogle || []).push({});Essa matéria Modelo atômico de Bohr, o que é? Definição, fundamentos e exemplos foi criada pelo site Conhecimento Científico.