Oxidação é o nome dado ao processo de perda de elétrons por um átomo, grupo ou espécie iônica durante uma reação química. Ela é identificada a partir do aumento do NOX (número de oxidação) da espécie ou átomo quando se comparam reagente e produto.
O termo oxidação foi inicialmente criado para denominar as reações nas quais o oxigênio era o reagente. Contudo, descobriu-se que em alguns casos, ocorriam na ausência desse elemento. Como o termo já era amplamente conhecido, continuou em uso.
As reações de oxidação ocorrem simultaneamente com as reações de redução. Por isso, são chamadas de oxirredução (redox), na qual existe a transferência de elétrons.
Sendo assim, em reações de oxirredução, o agente oxidante é o que aceita os elétrons, sofrendo redução, e o agente redutor perde os elétrons e sofre oxidação.
Como calcular NOX?
Conforme visto anteriormente, a oxidação é identificada a partir do NOX. Desse modo, para melhor entendimento, vamos propor um exemplo:
Fe + O2 → Fe2 + O3
Sendo assim, na equação acima, podemos indicar o NOX de cada um dos participantes:
Ferro no reagente (Fe): possui NOX 0 por ser uma substância simples; Oxigênio no reagente (O): possui NOX 0 por ser uma substância simples; Oxigênio no produto: possui NOX -2 por não estar ligado a um metal alcalino, alcalinoterroso ou hidrogênio. Assim formando peróxidos ou superóxidos; Ferro no produto: possui NOX +3, pois por ser uma substância composta, a somatória do NOX do ferro multiplicado por 2 (quantidade de átomos) + NOX do oxigênio multiplicado por 3, deve resultar em 0. Veja a seguir:x.2 + 3.(-2) = 0
2x – 6 = 0
2x = +6
x = + 6 /2
x = +3
Portanto, comparando o NOX do ferro do reagente (0) para o produto (+3), observamos um aumento, ou seja, ele sofreu o processo da oxidação.
Além disso, como visto anteriormente, a ocorrência desse processo vem sempre acompanhada do fenômeno da redução, identificada pela diminuição do NOX, como ocorre com o oxigênio no exemplo citado acima.

Biofísica – O que é, o que faz e relação da física e biologia
×Oxidação na Química Orgânica
O processo de oxidação pode ocorrer com hidrocarbonetos, especialmente os alcenos.
Esse processo na química orgânica apresenta quatro formas, assim sendo: a combustão, a ozonólise, a oxidação branda e a oxidação energética.
Desse modo, a seguir vamos conhece-las melhor.
CombustãoCombustão é toda reação química que ocorre na presença de um combustível qualquer e do comburente gás oxigênio (O2), resultando na produção de calor e luz.
O oxigênio tem como função oxidar o combustível, portanto, é o agente oxidante da combustão.
Contudo, a combustão pode ser completa ou incompleta. Assim sendo:
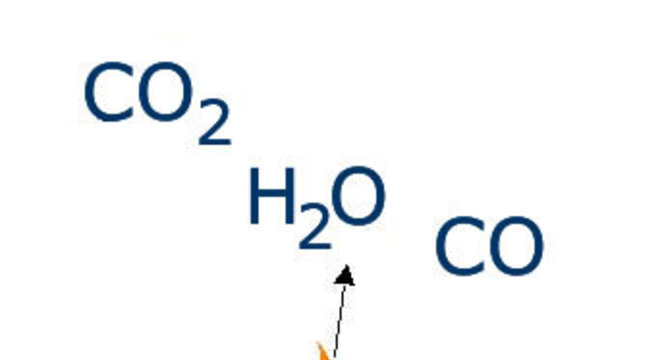
Combustão Completa: ocorre quando há suprimento suficiente de oxigênio. Ao final da reação, formam-se dióxido de carbono (CO2) e água (H2O).Exemplo:
Combustão Completa do do metano: CH4 + 2O2 → CO2 + 2H2O
Combustão Incompleta: não há suprimento suficiente de oxigênio, formam-se monóxido de carbono (CO) e água (H2O).Exemplo:
Combustão incompleta do butano com produção de monóxido de carbono: 2C4H10 + 9O2 → 8CO + 10H2O
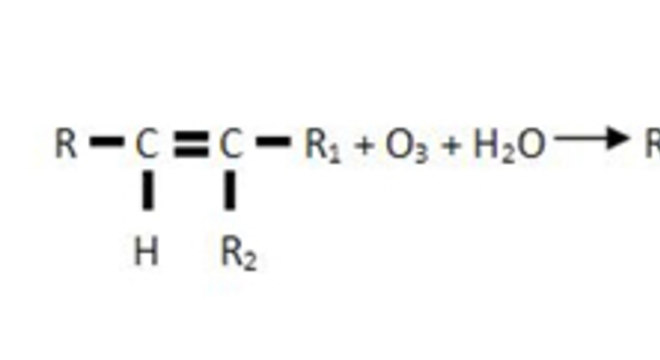
OzonóliseComo o próprio nome indica, o agente oxidante utilizado para romper a dupla ligação do alceno é o ozônio (O3). Portanto, quando a dupla ligação é quebrada, os carbonos passam a se ligar com os oxigênios do ozônio, produzindo o ozoneto (ou ozonídeo), que é instável e explosivo.
O ozonídeo, por sua vez, reage com água na presença de um agente redutor, como o zinco, e origina aldeídos e cetonas.
Sendo assim, genericamente temos:
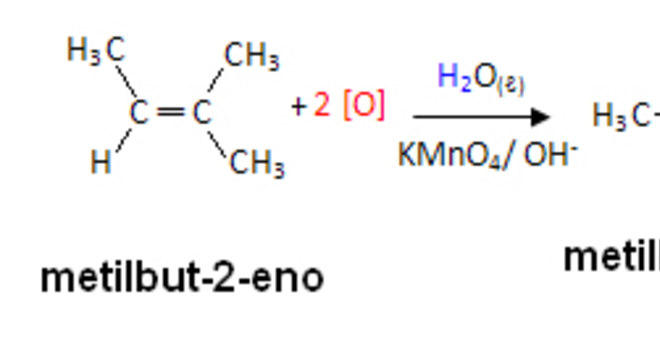
A oxidação branda ocorre quando o agente oxidante é um composto como o permanganato de potássio (KMnO4), presente em solução aquosa, diluída e resfriada, neutra ou ligeramente básica.
Esse tipo de processo ocorre com o uso do Teste de Baeyer, usado para diferenciar alcenos de ciclanos isômeros. Sendo assim, veja o exemplo abaixo:
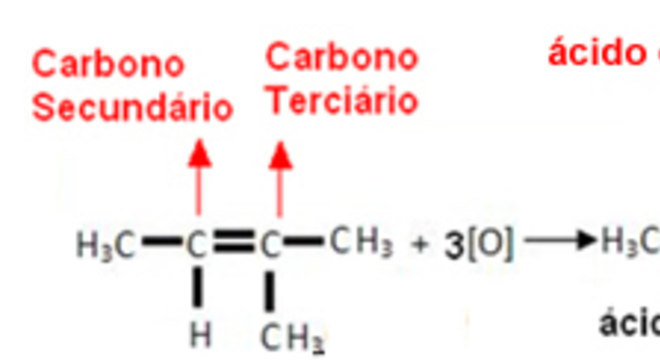
A diferença dessa oxidação para a anterior é que nesse processo a solução de permanganato de potássio está em meio ácido e a quente. Desse modo, a decomposição do permanganato, para originar o oxigênio atômico, se processa de modo mais energético.
Além disso, a oxidação do alceno também é mais energética, pois as duas ligações da ligação dupla são rompidas e os átomos de oxigênio se ligam ao carbono, podendo gerar os seguintes produtos:
Se o carbono da dupla for terciário:o produto será uma cetona; Se o carbono da dupla for secundário: o produto será um ácido carboxílico; Se o carbono da dupla for primário: o produto será o ácido carbônico, que se decompõe em dióxido de carbono (CO2) e água (H2O).Sendo assim, para melhor entendimento, veja esse exemplo abaixo:
Exemplos de Oxidação
Oxidação do FerroA ferrugem é a oxidação do ferro. Todos os metais podem sofrer oxidação. Portanto, ela ocorre devido o contato dos metais com o ar e a água.
Inicialmente, forma-se a corrosão que é o desgaste do metal, em virtude da oxidação. Logo em seguida, forma-se a ferrugem.
Sendo assim, veja a reação de oxirredução para formação da ferrugem:
Fe(s) → Fe2++ 2e–. Nessa etapa, o ferro perde dois elétrons, sofre a oxidação; O2+ 2 H2O + 4e– → 4OH–. Redução do O2; 2Fe + O2+ 2H2O → 2 Fe(OH)2. Equação Geral – O Fe(OH)2 é o Hidróxido de Ferro, responsável pela coloração castanha da ferrugem.Obs.: Para proteger o ferro e o aço da oxidação, pode-se utilizar a técnica de galvanização. Ela consiste no revestimento com zinco metálico. Entretanto, é um processo caro, tornando-se inviável em alguns casos.

Eletrólise é um processo químico em que uma solução aquosa contendo um sal é submetida a uma corrente elétrica, que acaba, portanto, promovendo a oxidação dos ânions presentes nesses materiais.
Sendo assim, em toda eletrólise, ocorre oxidação.
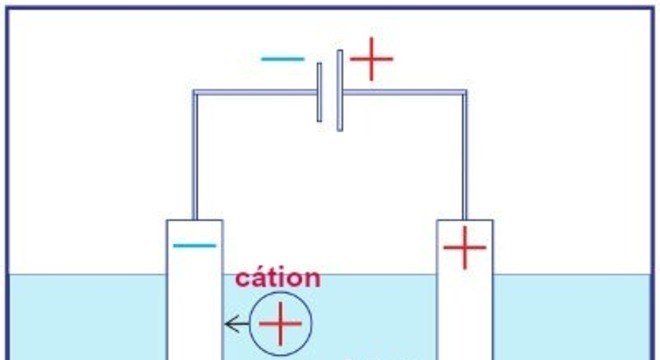
Pilhas ou baterias são dispositivos eletroquímicos que armazenam substâncias químicas. Portanto, uma dessas substâncias sofrerá oxidação, e a outra sofrerá redução.
Assim, resulta na produção de corrente elétrica.

Portanto, agora que você aprendeu tudo sobre esse processo, aprenda também como limpar prata.
Fontes: Brasil Escola, Toda Matéria, InfoEscola
Fonte Imagem Destaque: Global Color
Essa matéria Oxidação – O que é, como ocorre, reação na química orgânica e exemplos foi criada pelo site Conhecimento Científico.